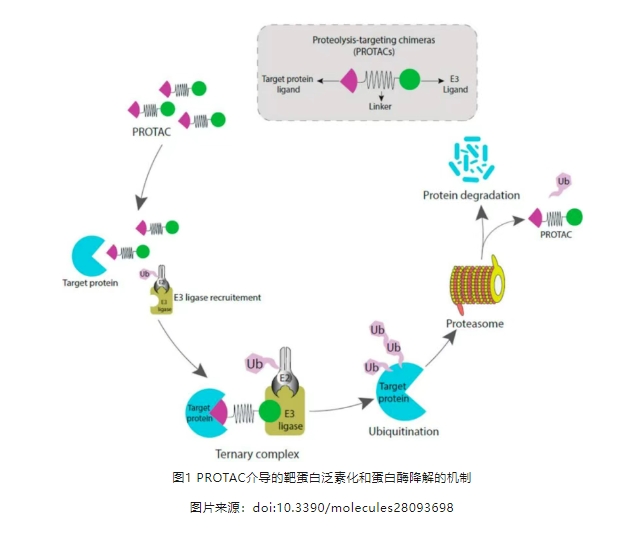
PROTAC(蛋白降解靶向嵌合体)作为新一代靶蛋白降解分子,以精妙的"分子三明治"结构重塑了药物设计的边界。PROTAC分子通过连接子,一端靶向目标靶蛋白,另一端结合E3泛素连接酶,给靶蛋白添加上泛素化标签,巧妙利用泛素-蛋白酶体系统降解靶蛋白。
PROTAC因为其独特的作用机制而成为创新药研发的热门研究方向,尤其是针对不可成药的靶点,受到业界广泛关注,被认为是突破当前小分子药物研发瓶颈最有希望的新技术之一。
历史演进,从实验室探索到临床突破
自2001年Crews团队合成首个MetAP2降解PROTAC以来,该领域历经“肽基时代”到“全小分子革命”的范式转变。早期基于多肽的PROTAC虽具靶向优势,却因分子量过大、肽键不稳定等缺陷,导致存在合成和纯化等诸多问题。随后研究者采取“全小分子”的PROTAC设计,“全小分子”PROTAC通过小分子配体去募集目标蛋白和E3泛素连接酶,快速靶向降解目标蛋白,并且分子有更好的稳定性、细胞渗透性和可合成性。2019年,Crews创立的公司ARVINAS开发的用于治疗前列腺癌的雄激素受体PROTAC全球首次开展临床试验,由此开启临床转化纪元。
如今,Vepdegestrant申报上市,标志着靶向蛋白降解技术从概念验证走向临床应用的重大突破。
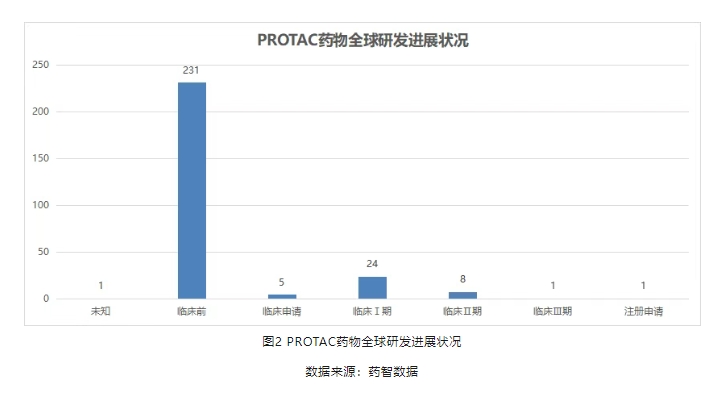
药智数据显示,截至目前,除Vepdegestrant外,全球已有已有超过270款PROTAC新药处于研发阶段,其中33款正处于临床阶段,昭示着这一领域的蓬勃生机。
代谢迷局,PROTAC研发的隐秘挑战
PROTAC虽然在成药性方面具有众多优势,但是基于新型的作用机制,完全采用小分子药物的临床前开发策略存在很多风险,2023年国际药物开发创新与质量联盟(IQ)靶向蛋白降解剂小组做了一项调查,针对18家研发靶向蛋白降解药物的企业,分析在临床前开发阶段大家公认的重要研发问题(图3)。
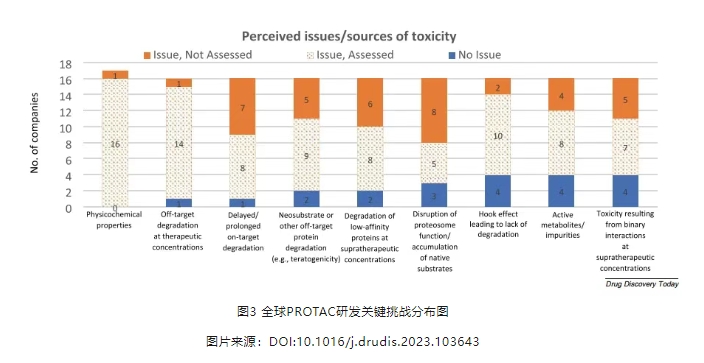
大部分企业认为理化性质为重要研究内容,并且均进行了评估研究;其余问题均与PROTAC的安全性研究有关,百分之七十五的企业认为PROTAC以及代谢物的脱靶毒性研究非常重要,但仍有百分之三十的企业没有进行评估研究,可能是由于缺乏有效的评估方法,就像沙利度胺对胎儿的致畸性一样,脱靶效应在非临床毒性研究中不易检测和跟踪。
PROTAC的代谢特征以及代谢产物的研究比小分子的代谢研究更复杂,PROTAC结构中的E3连接酶的种类、POI配体的稳定性、linker的长度、连接位点以及刚柔性的变化均会影响PROTAC的代谢,因此研究PROTAC分子的代谢特征以及代谢产物时,不能简单基于其各部分配体代谢特征的加合。
代谢解码,从实验探索到智能预测
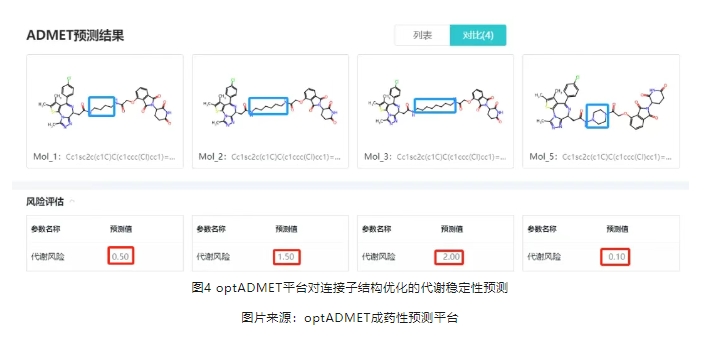
Goracci团队2020年在《Journal of Medicinal Chemistry》的开创性研究揭示了PROTAC代谢的复杂图景:连接子构型、配体稳定性、空间刚性等要素共同编织成精密代谢网络。研究显示,缩短连接子长度或引入刚性结构单元(如联苯基团)可显著提升代谢稳定性,这一发现与optADMET成药性预测平台的算法推演高度吻合(图4)。该平台通过深度学习模型,可以预测代谢稳定性以及代谢产物和产物比例等关键参数。
PROTAC分子作为一类新的化合物分子,整体分子的代谢产物与单独各部分的代谢产物差别非常大。以下图5分子的代谢为例,文献研究得出PROTAC的代谢产物主要集中在linker。我们利用optADMET成药性预测平台进行预测,与文献基本一致,结果见图6。
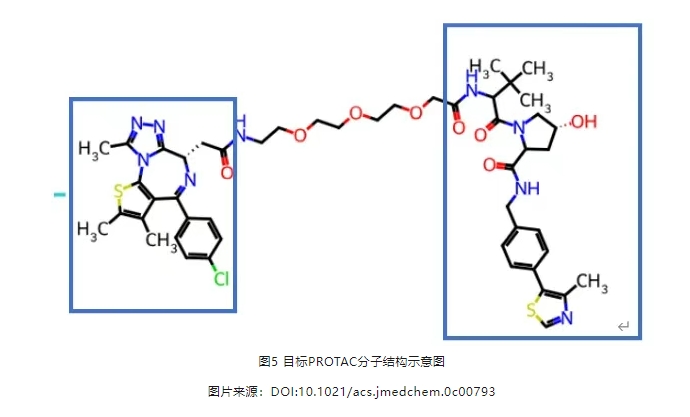
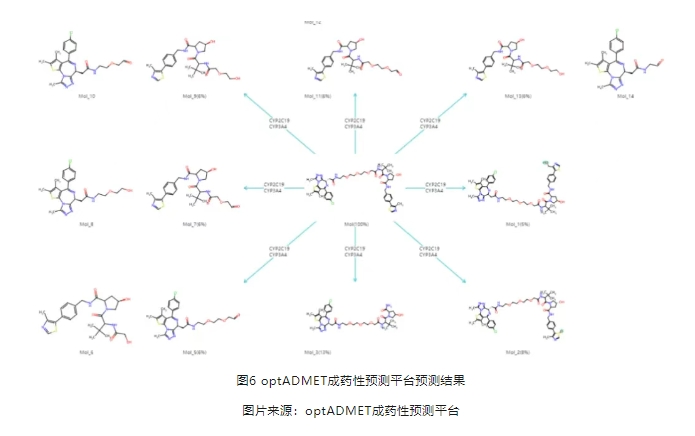
可以看到,利用optADMET成药性预测平台可以快速预知PROTAC的代谢特征,预知代谢风险。