招股书显示,岸迈生物已经建立了由9种自研抗体疗法组成的管线,除了核心管线EMB-01(靶向EGFR/cMET),其余8款均为CD3 T细胞衔接器。
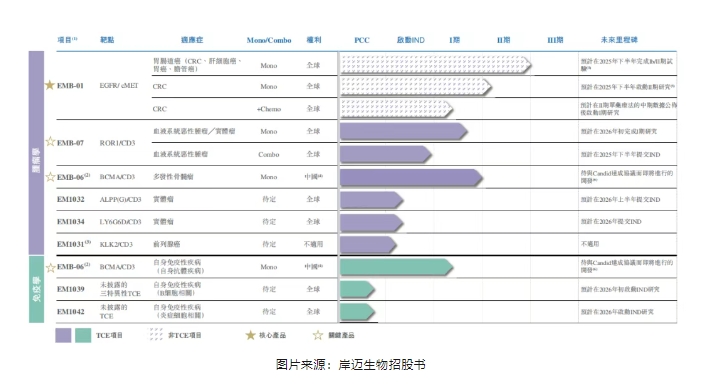
具体来看,肿瘤学领域,岸迈生物已有三款处于临床阶段的候选药物,包括核心产品EMB-01(靶向EGFR/cMET),两款基于T细胞衔接器的关键产品EMB-06(靶向BCMA/CD3)和EMB-07(靶向ROR1/CD3),及三款基于T细胞衔接器的临床前候选药物EM1032(靶向ALPP(G)/CD3)、EM1034(靶向LY6G6D/CD3)和EM1031(靶向KLK2/CD3)。
免疫学领域,岸迈生物已有一款处于临床阶段的候选药物,即基于T细胞衔接器的关键产品EMB-06,以及两款基于T细胞衔接器的临床前候选药物EM1039和EM1042。
>>核心产品EMB-01(EGFR/cMET)
EMB-01是一种同时靶向EGFR和cMET的四价双特异性抗体,有望成为全球率先上市的结直肠癌靶向EGFR/cMET双特异性抗体之一。
在重度经治转移性结直肠癌患者的Ib/II期研究中,EMB-01展现出良好疗效。截至2025年3月6日,在这项研究的44例可评价患者中,29例患者为左侧、RAS/RAF野生型转移性结直肠癌。在这29例患者中,7例实现部分应答(ORR为24.1%)及17例病情稳定(包括11例肿瘤缩小性病情稳定),DCR为82.8%。6例确诊应答者的中位DOR为32周,其中2例部分应答患者在数据截止时仍在接受治疗。在基线特征面临更大困难(如右侧、RAS/RAF突变)的其余可评价患者中,DCR达到46.7%。EMB-01在1,600毫克、每周一次的情况下亦表现出可耐受的安全性。
截至最后实际可行日期,全球尚无获批用于治疗结直肠癌的EGFR/cMET双特异性抗体。EMB-01是全球率先进入治疗结直肠癌II期试验的EGFR/cMET双特异性抗体,并有望成为全球率先上市的结直肠癌靶向EGFR/cMET双特异性抗体之一。
>>关键产品EMB-06(BCMA/CD3)
EMB-06是岸迈生物开发的首款T细胞衔接器,为一种用于治疗多发性骨髓瘤和自身免疫性疾病靶向BCMA和CD3的重组人源化双特异性抗体。
2024年底,EMB-06已完成R/R MM剂量递增阶段的I期临床试验,展现出强大的抗肿瘤活性,同时可保持良好的安全性。在最高评价剂量水平(120毫克至300毫克),EMB-06的整体应答率达到91.7%,完全应答率达33.3%。
值得注意的是,EMB-06的细胞因子释放综合征和神经毒性发生率均较低。EMB-06治疗R/R MM患者的I期研究报告,细胞因子释放综合征发生率仅为25%,且均为轻度(1级或2级)。
基于良好的安全性,EMB-06同时向自身免疫病领域拓展。2024年9月,岸迈生物与专注于开发治疗自身免疫疾病的T细胞接合分子的Vignette Bio,Inc.(后被Candid收购)就EMB-06达成合作,总金额可达6.35亿美元。
>>关键产品EMB-07(ROR1/CD3)
EMB-07是全球潜在同类首创双特异性抗体,可同时靶向CD3和ROR1。作为全球处于临床开发阶段的领先ROR1靶向T细胞衔接器,EMB-07有望成为治疗表达ROR1的癌症的新型疗法,解决包括血液肿瘤及实体瘤的肿瘤学领域中尚未被满足的关键需求。
截至最后实际可行日期,全球并无用于治疗淋巴瘤的已上市ROR1/CD3 T细胞衔接器,而全球有两款用于治疗淋巴瘤的临床阶段ROR1/CD3双特异性抗体候选药物。截至最后实际可行日期,EMB-07仍是中国唯一一款处于临床阶段的用于治疗淋巴瘤的ROR1/CD3双特异性抗体候选药物。
岸迈生物正在中国和澳大利亚开展EMB-07作为单药疗法治疗晚期实体瘤及淋巴瘤患者的I期试验研究,在剂量递增阶段观察到了淋巴瘤队列的初步疗效信号。
基于高潜力的自研管线,岸迈生物已建立多个全球对外授权合作,总交易价值超过21亿美元,于T细胞衔接器领域中排名全球第二。
除了上文提到的与Vignette Bio的合作,岸迈生物还在近期就KLK2/CD3 T细胞衔接器与Juri订立对外授权协议,总潜在交易价值最多为2.1亿美元。